Bộ đề thi hóa học kỳ 2 dưới đây được chúng tôi tổng hợp bởi các bộ đề tại các trường THCS trên toàn quốc. Hy vọng rằng, bạn sẽ tận dụng triệt để bộ tài liệu này để trau dồi kiến thức vững hơn, rèn luyện kỹ năng làm bài và phân bổ thời gian hợp lý để đạt điểm số cao nhất trong kỳ thi sắp tới.
Xem thêm: [DOWNLOAD] Đề cương ôn tập toán 6 học kì 1 có đáp án
Đề thi hóa 8 học kì 2 năm 2020- 2021

Đề số 1
|
PHÒNG GD&ĐT TAM ĐẢO |
ĐỀ KHẢO SÁT CHẤT LƯỢNG CUỐI NĂM MÔN: HÓA HỌC 8 Thời gian làm bài: 45 phút (không kể thời gian chép đề) |
Câu 1 (2,0 điểm). Lập phương trình hóa học của các phản ứng sau:
a)
b) Zn + HCl → ? + ?
c)
d) Ca + H2O → ? + ?
Câu 2 (4,0 điểm).
- Cho các oxit sau đây: Fe2O3, P2O5, SiO2, Na2O. Oxit nào là oxit bazơ? Viết công thức của bazơ tương ứng. Oxit nào là oxit axit? Viết công thức của axit tương ứng.
- Có 3 bình đựng riêng biệt các chất khí: không khí, O2, H2. Hãy nhận biết các chất khí trên bằng phương pháp hóa học.
Câu 3 (4,0 điểm).
Cho 10,4g hỗn hợp Mg và Fe tác dụng vừa đủ với dung dịch HCl 0,5M, tạo ra 6,72 lit khí H2 (ở đktc).
a) Viết các phương trình hoá học xảy ra?
b) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
c) Tính thể tích của dung dịch HCl 0,5M đã dùng?
Đáp án đề thi hóa lớp 8 học kì 2 – Đề 1
MÔN: HÓA HỌC 8
|
CÂU |
NỘI DUNG |
ĐIỂM |
||||||||||||
|
1 |
a) 2Mg + O2 → 2MgO b) Zn + 2HCl → ZnCl2 + H2 c) 4H2+ Fe3O4 → 3Fe + 4H2O d) Ca + 2H2O → Ca(OH)2 + H2 ↑ |
0,5 0,5 0,5 0,5 |
||||||||||||
|
2.a |
|
1,0 1,0 |
||||||||||||
|
2.b |
-Dẫn mỗi khí trong bình ra, để que đóm cháy còn tàn đỏ ở miệng ống dẫn khí thấy: Khí nào làm tàn đỏ bùng cháy là oxi. Phương trình: C + O2 → CO2 (1đ) Hai khí còn lại đem đốt, khí nào cháy trong không khí có ngọn lửa xanh nhạt là H2 Phương trình: 2H2 + O2 → 2H2O Khí còn lại là không khí. |
0,5 0,5 0,5 0,5 |
||||||||||||
|
3 |
a) Phương trình hóa học Mg + 2HCl → MgCl2 + H2 (1) |
0,5 |
||||||||||||
|
|
Fe + 2HCl → FeCl2 + H2 (2) |
0,5 |
||||||||||||
|
|
b) |
0,5 |
||||||||||||
|
|
Đặt số mol của Mg và Fe trong hỗn hợp lần lượt là x, y (x, y > 0), theo đề bài ta có 24x + 56y = 10,4 (*) |
0,5 |
||||||||||||
|
|
Theo Phương trình hóa học (1), (2) => x+y = 0,3 (**) |
0,5 |
||||||||||||
|
|
Từ (*), (**) => x= 0,2 mol = nMg, y = 0,1 mol = nFe |
0,5 |
||||||||||||
|
|
=> mMg = 0,2.24 = 4,8g; mFe = 0,1.56 = 5,6 g |
0,5 |
||||||||||||
|
|
c) Theo Phương trình hóa họcPhương trình hóa học (1), (2) => nHCl = 2x+2y=0,6 mol, => Vdung dịch HCl = 0,6/0,5=1,2 (lit) |
0,5 |
||||||||||||
|
|
Tổng điểm |
10,0 |
Đề số 2
|
PHÒNG GD&ĐT VĨNH TƯỜNG |
ĐỀ KIỂM TRA HỌC KỲ II Môn: Hóa học- Lớp 8 Thời gian làm bài: 45 phút (Không kể thời gian giao đề) |
A. Phần trắc nghiệm (2,0 điểm): Hãy chọn đáp án đúng trong các câu sau:
Câu 1. Trong các dãy chất sau đây, dãy chất nào làm quì tím chuyển màu xanh?
A. KClO3, NaCl, FeSO4, MgCO3.
B. CaO, SO3, BaO, Na2O.
C. Ca(OH)2, KOH, NaOH, Ba(OH)2.
D. HCl, HNO3, H2SO4, H3PO4.
Câu 2. Xét các chất: Na2O, KOH, MgSO4, Ba(OH)2, HNO3, HCl, Ca(HCO3)2. Số oxit; axit; bazơ, muối lần lượt là:
A. 1; 2; 2; 3.
B. 1; 2; 2; 2.
C. 2; 2; 1; 2.
D. 2; 2; 2; 1
Câu 3. Nồng độ % của một dung dịch cho biết
A. Số gam chất tan có trong 100g nước.
B. Số gam chất tan có trong 1000ml dung dịch.
C. Số gam chất tan có trong 100ml nước.
D. Số gam chất tan có trong 100g dung dịch.
Câu 4. Biết độ tan của KCl ở 300C là 37. Khối lượng nước bay hơi ở 300C từ 200g dung dịch KCl 20% để được dung dịch bão hòa là:
A. 52 gam.
B. 148 gam.
C. 48 gam
D. 152 gam
II. Phần tự luận (8,0 điểm)
Câu 5. Hoàn thành các phương trình hóa học sau và cho biết chúng thuộc loại phản ứng gì?:
K + ?→ KOH + H2
Al + O2 →?
FexOy + O2→ Fe2O3
KMnO4 → ? + MnO2 + O2
Câu 6. Nêu phương pháp nhận biết các chất khí sau: Khí nitơ, hiđro, oxi, cacbon đioxit, và khí metan (CH4). Viết PTHH nếu có?
Câu 7. Cho 5,4 gam bột Nhôm tác dụng vừa đủ với 400ml dung dịch HCl
a, Tính nồng độ mol/lít dung dịch HCl đã dùng?
b, Lượng khí Hidro thu được ở trên cho qua bình đựng 32g CuO nung nóng thu được m gam chất rắn. Tính % khối lượng các chất trong m?
Đáp án đề thi hóa lớp 8 học kì 2 – Đề 2
A. Phần trắc nghiệm: (2,0 điểm)
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
C |
B |
D |
A |
|
Thang điểm |
0,5 |
0,5 |
0,5 |
0,5 |
B. Phần tự luận: (8đ)
|
Câu |
Nội dung |
Điểm |
|
Câu 1 (3đ) |
2K + 2H2O →2 KOH + H2 (Phản ứng thế) 4Al + 3O2→ 2Al2O3 (Phản ứng hóa hợp) 4FexOy +(3x- 2y)O2→ 2xFe2O3 (Phản ứng hóa hợp) 2 KMnO4→ K2MnO4 + MnO2 + O2 (Phản ứng phân hủy) (HS xác định sai mỗi phản ứng trừ 0,25đ) |
0,75đ 0,75đ 0,75đ 0,75đ |
|
Câu 2 (2đ) |
● Dùng dung dịch nước vôi trong nhận ra khí CO2 Phương trình hóa học: CO2 + Ca(OH)2 → CaCO3 + H2O ● Dùng tàn đóm đỏ nhận ra khí O2 Phương trình hóa học: C + O2 → CO2 ● Ba khí còn lại dẫn qua bột CuO nung nóng, khí làm đổi màu CuO thành đỏ gạch là khí H2 Phương trình hóa học: CuO + H2O → Cu + H2O Hai khí còn lại đem đốt, khí cháy được là CH4, còn lại là Nitơ Phương trình hóa học: CH4 +2O2 → CO2 + 2H2O |
0,5đ 0,5đ 0,5đ 0,5đ |
|
Câu 7 (3đ) |
Đổi 400 ml = 0,4l Phương trình hóa học: 2Al + 6HCl →2AlCl3 + 3H2 (1) nAl = 5,4/27 = 0,2 (mol) Theo Phương trình hóa học (1) nHCl = 3nAl = 3. 0,2 = 0,6 (mol) CM dd HCl = 0,6/0,4 = 1,5M Theo PTHH (1) nH2 = 3/2nAl = 3/2.0,2 = 0,3 (mol) nCuO = 32/80 = 0,4 (mol) Phương trình hóa học: CuO + H2 → Cu+H2O Trước phản ứng: 0,4 0,3 (mol) Khi phản ứng: 0,3 0,3 0,3 (mol) Sau phản ứng: 0,1 0 0,3 (mol) →mCuO dư = 0,1. 80 = 8(g) mCu = 0,3. 64 = 19,2(g) Trong m có 8 g CuO dư và 19,2g Cu %CuO = 8/27,2.100% = 29,4%; %Cu = 70,6% (Học sinh làm theo cách khác đúng vẫn cho điểm tối đa) |
0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ |
Đề số 3
Phần 1. Trắc nghiệm (4 điểm)
Câu 1. Trong các phản ứng hóa học sau, phương trình hóa học thuộc loại phản ứng thế là:
A. CaO + H2O → Ca(OH)2
B. Fe + H2SO4 → FeSO4 + H2
C. CaCO3 → CaO + CO2
D. 5O2 + 4P → 2P2O5
Câu 2. Độ tan của chất khí trong nước sẽ tăng nếu:
A. Giảm nhiệt độ và giảm áp suất
B. Tăng nhiệt độ và giảm áp suất
C. Giảm nhiệt độ và tăng áp suất
D. Tăng nhiệt độ và tăng áp suất
Câu 3. Chất nào sau đây được dùng để điều chế oxi trong phòng thí nghiệm:
A. K2O và KMnO4
B. KMnO4 và KClO3
C. H2SO4 và H2O
D. KOH và KClO3
Câu 4. Các chất nào sau đây tan được trong nước:
A. NaCl, AgCl.
B. HNO3, H2SiO3.
C. NaOH, Ba(OH)2.
D. CuO, AlPO4.
Câu 5. Hòa tan 5 g muối ăn vào 45 gam nước. Nồng độ phần trăm của dung dịch thu được là:
A. 5%
B. 10%
C. 15%
D. 20%
Câu 6. Dãy các chất hoàn toàn là công thức hóa học của các oxit:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO
D. SO2, CaO, KClO3, NaOH, SO3
Câu 7. Khí hidro tác dụng được với tất cả các chất của nhóm chất nào dưới đây?
A. CuO, FeO, O3
B. CuO, FeO, H2
C. CuO, Fe2O3, H2SO4
D. CuO, CO, HCl
Phần 2. Tự luận (6 điểm)
Câu 1. (1,5 điểm) Hoàn thành các phương trình hóa học sau:
A. K2O + H2O →
B. Na + H2O →
C. Cu + O2 →
D. CxHy+ O2 →
Câu 2. (1,0 điểm) Hãy dự đoán hiện tượng xảy ra và giải thích hiện tượng trong mỗi trường hợp sau:
a) Khi quạt gió vào bếp củi vừa mới tắt
b) Khi quạt gió vào ngọn nến đang cháy
Câu 3. ( 2,5 điểm) Đốt cháy hoàn toàn 6,9 gam Natri thì cần V lít khí oxi đo ở (đktc).
a) Viết phương trình hóa học của phản ứng xảy ra
b) Tính thể tích của khí Oxi đã dùng
c) Toàn bộ sản phẩm đem hòa tan hết trong nước thì thu được 180g dung dịch A. Tính nồng độ phần trăm của dung dịch A.
Câu 4. (1 điểm) Cho 24 gam hỗn hợp oxit CuO và Fe2O3 tác dụng hoàn toàn với hidro có dư thu được 17,6 gam hỗn hợp hai kim loại. Tìm khối lượng nước tao thành.
Cho nguyên tử khối của các nguyên tố: Cu = 64, O = 16, Cl = 35,5, Fe = 56, H = 1, Na = 23
Đáp án đề thi hóa lớp 8 học kì 2 – Đề 3
Phần 1. Trắc nghiệm (4 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
A |
C |
B |
C |
B |
A |
A |
Phần 2. Tự luận ( 6 điểm)
Câu 1.
A. K2O + H2O → 2KOH
B. 2Na + 2H2O → 2NaOH + H2
C. 2Cu + O2 → 2CuO
D.
Câu 2.
a) Lửa sẽ bùng cháy, do khi quạt gió vào bếp củi thì lượng oxi tăng lên.
b) Nến sẽ tắt do khi quạt gió vào ngọn nến đang cháy sẽ làm nhiệt độ hạ thấp đột ngột
Câu 3.
a) Phương trình hóa học: 4Na + O2 → 2Na2O (1)
b)
Theo phương trình (1)
=> VO2= 0,075.22,4 = 1,68 lít
c) Phương trình hóa học: Na2O + H2O → 2NaOH (2)
Theo phương trình (1)
Theo phương trình 2
nNaOH = 0,15.2 = 0,3 mol
=> mNaOH = 0,3.40 = 12 gam
Câu 4.
Đặt số mol H2O tạo thành là x mol
Ta có số mol H2 phản ứng = số mol H2O = x mol
Áp dụng định luật bảo toàn khối lượng ta có
24 + 2x = 17,6 + 18x
x = 0,4 mol
Khối lượng nước là: 0,4 x 18 = 7,2 gam
………….
Đề kiểm tra học kì 2 lớp 8 môn Hóa học
Tiếp theo là một số đề kiểm tra học kì 2 lớp 8 môn Hóa mà chúng tôi sưu tầm bao gồm đề trắc nghiệm và tự luận. Đây là hệ thống đề thi được lấy từ thư viện đề của các trường THCS trên toàn quốc. Hy vọng rằng sẽ giúp bạn ôn tập và rèn luyện kiến thức hiệu quả nhất.
Hy vọng rằng 30 đề thi hóa học kì 2 trên đây là sẽ nguồn tài liệu hữu ích giúp các em học sinh rèn luyện hiệu quả và đạt điểm số cao nhất trong kỳ thi sắp tới.


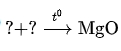
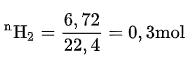
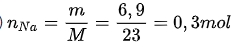
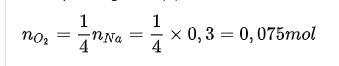
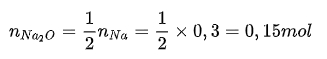
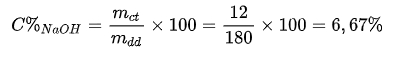






![50+ Đề thi học kì 2 Toán 11 năm 2022 mới nhất [Có đáp án]](https://seolalen.vn/wp-content/uploads/2022/09/de-thi-hoc-ky-2-lop-11-mon-toan-120x86.jpg)