Cân bằng phương trình là phần kiến thức trọng tâm nhất của chương trình Hóa Học lớp 8 mà các em học sinh cần nắm vững để áp dụng vào những bài tập, bài kiểm tra và cả quá trình học lâu dài sau này. Hiểu được điều đó, Seo Là Lên sẽ giới thiệu tới các em học sinh và thầy cô bộ bài tập cân bằng phương trình Hóa Học lớp 8 có kèm đáp án đầy đủ, chi tiết nhất để ôn luyện. Cùng tham khảo ngay trong bài viết dưới đây nhé!
Xem thêm: Download trọn bộ bài tập Hóa lớp 8 (Link Google Drive)
Download trọn bộ bài tập cân bằng phương trình Hoá Học lớp 8
Tải bộ bài tập cân bằng phương trình Hóa Học lớp 8 miễn phí: TẠI ĐÂY

Nếu trong quá trình bạn tải về từ google drive có thông báo như nội dung bên dưới bạn hãy đăng nhập gmail vào để tải, hoặc bạn mở bằng trình duyệt khác để tải bạn nhé. Nếu không tải được mail cho chúng tôi theo email: seolalen.vn@gmail.com chúng tôi sẽ gửi lại file setup cho bạn
Rất tiếc, hiện tại bạn không thể xem hoặc tải xuống tệp này.
Gần đây, có quá nhiều người dùng đã xem hoặc tải xuống tệp này. Vui lòng truy cập lại tệp này sau. Nếu tệp mà bạn truy cập rất lớn hoặc bị chia sẻ với nhiều người, bạn có thể mất đến 24 giờ để có thể xem hay tải tệp xuống. Nếu bạn vẫn không thể truy cập tệp này sau 24 giờ, hãy liên hệ với quản trị viên tên miền của bạn.
Giới thiệu bộ bài tập cân bằng phương trình Hoá Học lớp 8 chi tiết
Bộ bài tập về cân bằng phương trình Hoá Học lớp 8 gồm có 2 phần là lý thuyết và bài tập có đáp án để các em học sinh tiện ôn luyện và đối chiếu, so sánh. Cùng tìm hiểu chi tiết hơn về bộ tài liệu này ngay sau đây nhé!
Khái niệm cân bằng phương trình hóa học
Mỗi phương trình hoá học sẽ thể hiện những phản ứng hoá học khác nhau. Cân bằng phương trình hoá học sẽ giúp bạn giải quyết được những bài toán về các phản ứng hoá học từ cơ bản đến nâng cao một cách dễ dàng nhất.

Hướng dẫn cân bằng phương trình hóa học
Bước 1: Thiết lập sơ đồ phản ứng
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố
Bước 3: Viết phương trình hóa học.
Phương pháp 1: Chắn – lẻ
Phương pháp này sẽ thêm hệ số vào trước chất có chỉ số lẻ để làm chẵn số nguyên tử của nguyên tố đó sau đó mới thực hiện cân bằng.
Ví dụ: Cân bằng phương trình: Al + HCl → AlCl3 + H2
Giải:
Ta chỉ việc thêm hệ số 2 vào trước AlCl3 để cho số nguyên tử Cl chẵn. Khi đó, vế phải có 6 nguyên tử Cl trong 2AlCl3, nên vế trái thêm hệ số 6 trước HCl.
Al + 6HCl → 2AlCl3 + H2
Vế phải có 2 nguyên tử Al trong 2AlCl3, vế trái ta thêm hệ số 2 trước Al.
2Al + 6HCl → 2AlCl3 + H2
Vế trái có 6 nguyên tử H trong 6HCl, nên vế phải ta thêm hệ số 3 trước H2.
2Al + 6HCl → 2AlCl3 + 3H2
Phương pháp 2: Đại số
Các bước tiến hành lập phương trình hoá học theo phương pháp đại số:
- Bước 1: Đưa các hệ số hợp thức a, b, c, d, e, f, … vào trước các công thức hóa học biểu diễn các chất ở cả hai vế của phản ứng.
- Bước 2: Cân bằng số nguyên tử ở 2 vế của phương trình bằng một hệ phương trình chứa các ẩn là các hệ số a, b, c, d, e, f, g….
- Bước 3: Giải hệ phương trình vừa lập để tìm các hệ số.
- Bước 4: Đưa các hệ số vừa tìm vào phương trình phản ứng hóa học để hoàn thành phản ứng.
Lưu ý: Phương pháp này sẽ giải được các ẩn số áp dụng với phương trình phản ứng phức tạp. Hệ số thu được sau khi giải là số nguyên dương tối giản nhất.
Ví dụ: Cân bằng phương trình Cu + H2SO4 đặc, nóng → CuSO4 + SO2 + H2O (1)
Giải:
Bước 1: Đặt các hệ số được kí hiệu là a, b, c, d, e vào phương trình trên ta có:
aCu + bH2SO4 đặc, nóng → cuSO4 + dSO2 + eH2O
Bước 2: Tiếp theo lập hệ phương trình dựa vào mối quan hệ về khối lượng giữa các chất trước và sau phản ứng, (khối lượng nguyên tử của mỗi nguyên tố ở 2 vế phải bằng nhau).
Cu: a = c (1)
S: b = c + d (2)
H: 2b = 2e (3)
O: 4b = 4c + 2d + e (4)
Bước 3: Giải hệ phương trình bằng cách:
Từ pt (3), chọn e = b = 1 (có thể chọn bất kỳ hệ số khác).
Từ pt (2), (4) và (1) => c = a = d = 1/2 => c = a = d = 1; e = b =2 (tức là ta đang quy đồng mẫu số).
Bước 4: Đưa các hệ số vừa tìm vào phương trình phản ứng, ta được phương trình hoàn chỉnh.
Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O
Phương pháp 3: Cân bằng phương trình bằng phương pháp thăng bằng electron
Bước 1. Viết sơ đồ phản ứng với các chất tham gia xác định nguyên tố có số oxi hóa thay đổi
Bước 2. Viết phương trình:
Khử (Cho electron)
Oxi hóa (nhận electron)
Bước 3. Cân bằng electron: Nhân hệ số để
Tổng số electron cho = tổng số electron nhận
Bước 4. Cân bằng nguyên tố: nói chung theo thứ tự
Kim loại (ion dương)
Gốc axit (ion âm)
Môi trường (axit, bazo)
Nước (cân bằng H2O là để cân bằng hidro)
Bước 5. Kiểm tra số nguyên tử oxi ở hai vế (phải bằng nhau)
Ví dụ: Cân bằng phương trình: Cu + HNO3 → Cu(NO3)2+ NO + H2O
Giải:
Xác định sự thay đổi số oxi hóa
Cuo + HN+5O3→ Cu+2(NO3)2+ N+2O + H2O
Sau đó thêm 6 gốc NO3- (tron đó N không thay đổi số oxi hóa) nghĩa là tất cả có 8HNO3
Cuối cùng ta có
3Cu + 8HNO3→ 3Cu(NO3)2 + 2NO↑ + 4H2O
Bài tập cân bằng phương trình hóa học lớp 8 có lời giải
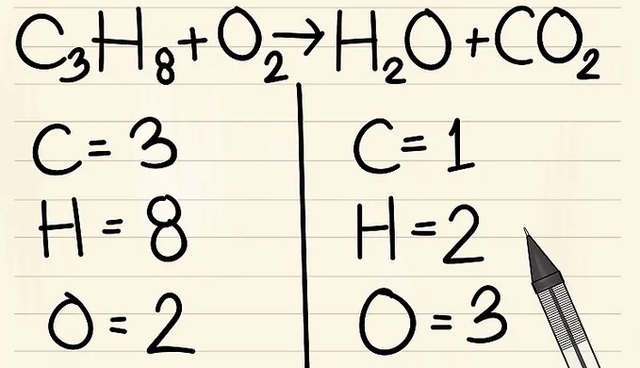
Dạng 1: Cân bằng các phương trình hóa học
1) MgCl2 + KOH → Mg(OH)2 + KCl
2) Cu(OH)2 + HCl → CuCl2 + H2O
3) Cu(OH)2 + H2SO4 → CuSO4 + H2O
4) FeO + HCl → FeCl2 + H2O
5) Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
6) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO3
7) P + O2 → P2O5
8) N2 + O2 → NO
9) NO + O2 → NO2
10) NO2 + O2 + H2O → HNO3
11) Na2O + H2O → NaOH
12) Ca(OH)2 + Na2CO3 → CaCO3 + NaOH
13) Fe2O3 + H2 → Fe + H2O
14) Mg(OH)2 + HCl → MgCl2 + H2O
15) FeI3 → FeI2 + I2
16) AgNO3 + K3PO4 → Ag3PO4 + KNO3
17) SO2 + Ba(OH)2 → BaSO3 + H2O
18) Ag + Cl2 → AgCl
19) FeS + HCl → FeCl2 + H2S
20) Pb(OH)2 + HNO3 → Pb(NO3)2 + H2O
Đáp án cân bằng phương trình hóa học
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl
2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
3) Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
4) FeO + 2HCl → FeCl2 + H2O
5) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
6) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
7) 4P + 5O2 → 2P2O5
8) N2 + O2 → 2NO
9) 2NO + O2 → 2NO2
10) 4NO2 + O2 + 2H2O → 4HNO3
11) Na2O + H2O → 2NaOH
12) Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
13) Fe2O3 + 3H2 → 2Fe + 3H2O
14) Mg(OH)2 + 2HCl → MgCl2 + H2O
15) 2FeI3 → 2FeI2 + I2
16) 3AgNO3 + K3PO4 → Ag3PO4 + 3KNO3
17) SO2 + Ba(OH)2 → BaSO3 + H2O
18) 2Ag + Cl2 → 2AgCl
19) FeS + 2HCl → FeCl2 + H2S
20) Pb(OH)2 + 2HNO3 → Pb(NO3)2 + 2H2O
Dạng 2. Chọn hệ số và công thức hóa học phù hợp điền vào dấu hỏi chấm trong phương trình hóa học
- a) Al2O3 + ? → ?AlCl3 + ?H2O
- b) H3PO4 + ?KOH → K3PO4 +?
- c) ?NaOH + CO2 → Na2CO3 + ?
- d) Mg + ?HCl → ? +?H2
- e) ? H2 + O2 → ?
- f) P2O5 +? → ?H3PO4
- g) CaO + ?HCl → CaCl2 + H2O
- h) CuSO4 + BaCl2 → BaSO4 + ?
Đáp án cân bằng phương trình
- a) Al2O3 + 6HCl → 2AlCl3 +3H2O
- b) H3PO4 + 3KOH → K3PO4 + 3H2O
- c) 2NaOH + CO2 → Na2CO3 + H2O
- d) Mg + 2HCl → MgCl2 + H2
- e) 2H2 + O2 → 2H2O
- f) P2O5 + 3H2O → 2H3PO4
- g) CaO + 2HCl → CaCl2 + H2O
- h) CuSO4 + BaCl2 → BaSO4 + CuCl2
Dạng 3. Lập sơ đồ nguyên tử và cho biết số phân tử mỗi chất sau phản ứng hóa học
Cho sơ đồ của các phản ứng sau:
a) Na + O2 → Na2O
b) P2O5 + H2O → H3PO4
c) HgO → Hg + O2
d) Fe(OH)3 → Fe2O3 + H2O
Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng
Lời giải: Đề bài khá khó hiểu, tuy nhiên cứ cân bằng phương trình hóa học thì mọi hướng đây sẽ rõ. Bài này đơn giản nên nhìn vào là có thể cân bằng được ngay nhé:
a) 4Na + O2 → 2Na2O
Tỉ lệ: số nguyên tử Na: số phân tử O2: số phân tử Na2O = 4 : 1 : 2. (Oxi không được để nguyên tố mà phải để ở dạng phân tử tương tự như hidro)
b) P2O5 + 3H2O → 2H3PO4
Tỉ lệ: Số phân tử P2O5: số phân tử H2O: số phân tử H3PO4 = 1 : 3 : 2.
c) 2HgO → 2Hg + O2
Tỉ lệ: số phân tử HgO: số nguyên tử Hg: số phân tử O2 = 2 : 2 : 1. (lý giải tương tự câu a), Oxi phải để ở dạng phân tử)
d) 2Fe(OH)3 → Fe2O3 + 3H2O
Tỉ lệ: số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3. (phương trình này chưa có điều kiện xúc tác nên phản ứng sẽ khó xảy ra hoặc xảy ra nhưng thời gian là khá lâu)
Dạng 4: Cân bằng PTHH hợp chất hữu cơ tổng quát
1) CnH2n + O2 → CO2 + H2O
2) CnH2n + 2 + O2 → CO2 + H2O
3) CnH2n – 2 + O2 → CO2 + H2O
4) CnH2n – 6 + O2 → CO2 + H2O
5) CnH2n + 2O + O2 → CO2 + H2O
Đán án
Dạng 5*. Cân bằng các phương trình hóa học sau chứa ẩn
1) FexOy+ H2 → Fe + H2O
2) FexOy + HCl → FeCl2y/x + H2O
3) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2(SO4)n + SO2 + H2O
5) M + HNO3 → M(NO3)n + NO + H2O
6) FexOy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
7) Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O
Đáp án
1) FexOy + yH2 → xFe + yH2O
2) FexOy + 2yHCl → xFeCl2y/x + yH2O
(3) 2FexOy+2yH2SO4 → xFe2(SO4)2y/x + 2yH2O
4) 2M + 2nH2SO4 → M2(SO4)n + nSO2 +2nH2O
5) M + 2nHNO3 → M(NO3)n + 2nNO + H2O
7) (5x – 2y) Fe3O4 + (46x – 18y) HNO3 → 3(5x – 2y) Fe(NO3)3 + NxOy + (23x – 9y)H2O
Lưu ý quan trọng: Phân tử không bao giờ chia đôi, do đó dù cân bằng theo phương pháp nào thì vẫn phải đảm bảo một kết quả đó là các hệ số là những số nguyên.
>>> Xem thêm các dạng bài cân bằng phương trình hoá học: TẠI ĐÂY
Trên đây là hướng dẫn cách tải trọn bộ bài tập cân bằng phương trình Hoá Học lớp 8 có đáp án miễn phí chi tiết nhất. Hy vọng bài viết đã cung cấp cho bạn những thông tin hữu ích nhất. Trân trọng!


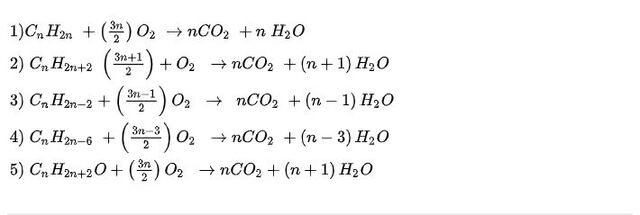






![50+ Đề thi học kì 2 Toán 11 năm 2022 mới nhất [Có đáp án]](https://seolalen.vn/wp-content/uploads/2022/09/de-thi-hoc-ky-2-lop-11-mon-toan-120x86.jpg)